a highly thermostable reverse transcriptase
UltraScript® 2.0 Reverse Transcriptase & Kits UltraScript® 2.0 Reverse Transcriptase は、優れた cDNA 合成速度、収量、および最も困難な RNA サンプル タイプを表現するために設計された、非常に耐熱性の高い逆転写酵素です。
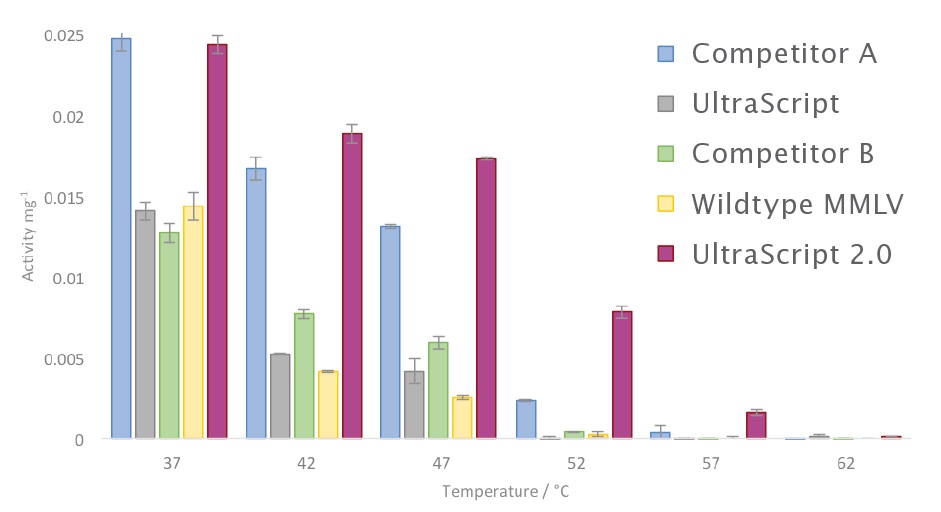
この改良された MMLV 逆転写酵素は、55°C を超える反応温度で使用できるため、特異性が向上し、cDNA 収量が増加し、完全長 cDNA 産物が増えます。
55℃~65℃以上の高耐熱性逆転写酵素
先進的なRNase阻害剤
わずか20pgの総RNAから高いcDNA収量
GCリッチで高度に構造化された転写産物の正確な逆転写
難しいテンプレートに対する高い感度
RNase H 活性の減少
バッファー付きのスタンドアロン酵素、プレミックスオリゴを含むcDNA合成キット、および個別のオリゴを含むcDNA合成キットとして利用可能
PCR 分析、クローニング、ライブラリ作成、次世代シーケンシング用の cDNA 合成
ウイルス RNA ターゲット
miRNA ターゲット
全 RNA またはポリ (A)+ RNA からの効率的な合成
UltraScript® 2.0 Reverse Transcriptase とは? UltraScript® 2.0 Reverse Transcriptase (RTase) の強化された耐熱性により、55°C を超える反応温度が使用可能になり、特異性が向上し、cDNA 収量が増加し、完全長 cDNA 産物が増加します。この酵素は 90°C まで部分的に活性を保ち、GC リッチで高度に構造化された転写物を含む最も困難な RNA テンプレートの効率的な逆転写用に設計されています。
UltraScript® 2.0 RTase は、幅広い RNA 濃度から効率的に cDNA を合成できるように設計されています。UltraScript® 2.0 Kit は、20 pg ~ 3.5 μg のトータル RNA またはオリゴ (dT) 精製 mRNA とともに使用できます。RTase には、RNase の汚染による RNA の分解を防止する高度な RNase阻害剤
UltraScript® 2.0 RTase は、それぞれ dNTP、MgCl2 、RNase阻害剤
2-tube UltraScript® 2.0 cDNA Synthesis Kit には、アンカー オリゴ (dT) とランダム ヘキサマーの最適化されたブレンドなど、高速で信頼性が高く偏りのない cDNA 合成に必要なすべてのコンポーネントが含まれています。UltraScript® 2.0 cDNA Synthesis Kit Separate Oligos は、必要な分析の種類に応じてユーザーが最適化できるように、アンカー オリゴ (dT) とランダム ヘキサマーを別々のチューブで提供します。
UltraScript® 2.0 Reverse Transcriptase は、競合製品や当社オリジナルの UltraScript® Reverse Transcriptase
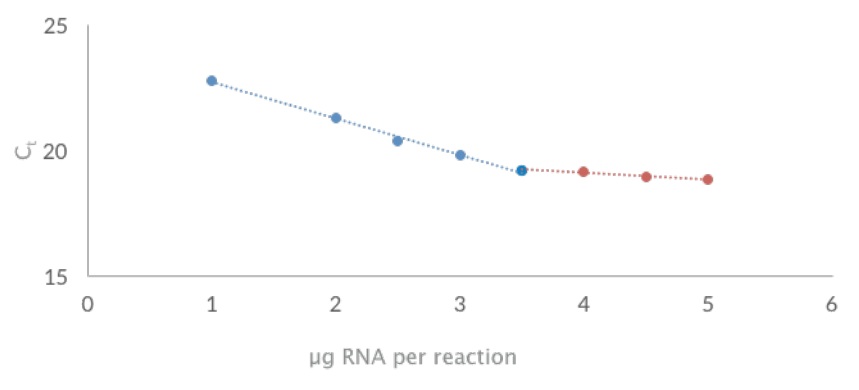
UltraScript® 2.0 Reverse Transcriptase を使用してマウス肝臓の全 RNA を逆転写し、続いて qPCRBIO SyGreen® Mix UltraScript 2.0 Reverse Transcriptase は、線形応答を維持しながら最大 3.5 μg の RNA を転写できます。
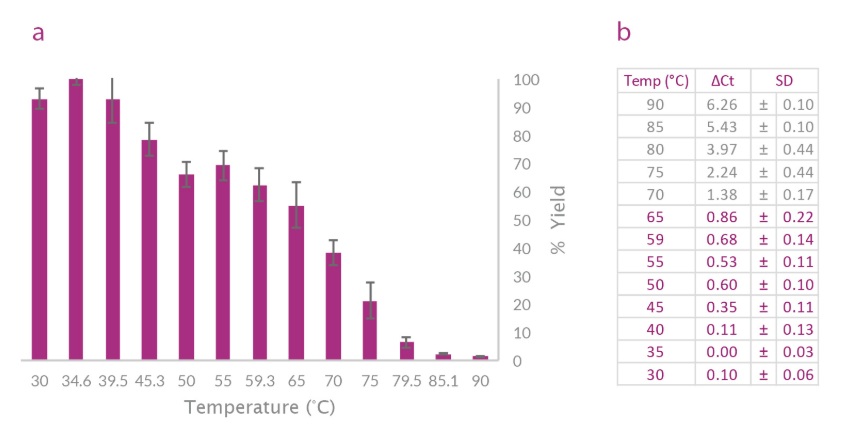
マウス肝臓の全RNAをUltraScript® 2.0 Reverse Transcriptase で逆転写し、続いてqPCRBIO SyGreen® Mix UltraScript® 2.0 Reverse Transcriptase は、ΔCt値が±1 Ctの範囲内で収量にほとんど変化を示さず(b)、90°Cまで部分的に活性を維持します(aとb)。
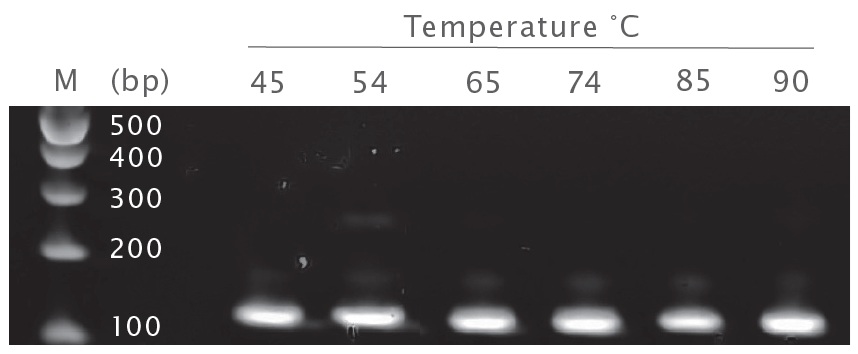
UltraScript® 2.0 Reverse Transcriptase は、エンドポイント RT-PCR の広範囲の温度にわたって同様の量の生成物を生成します。マウス参照 RNA は、UltraScript® 2.0 Reverse Transcriptase を使用して逆転写されました。G-Act cDNA を qPCRBIO SyGreen® Mix
UltraScript® 2.0 Reverse Transcriptase
UltraScript® 2.0 cDNA Synthesis Kit
UltraScript® 2.0 cDNA Synthesis Kit Separate Oligos
長いターゲット (15 ~ 20 kb) を UltraScript® 2.0 RTase で逆転写できますか?
RTase はプライミングされた基質にジャンプオンしたりジャンプオフしたりするため、PCR Biosystems 社のすべての RTase で 20 kb の RNA 逆転写を実現できます。二次構造、非特異的結合、およびミスプライミングは、反応が途中で終了する最も一般的な原因となります。
特定のプライマーまたはオリゴ (dT) を使用し、反応の各側面 (たとえば、さまざまな酵素濃度、プライマー、プライマー濃度、温度、温度サイクル、時間など) を最適化することをお勧めします。また、その後の PCR/qPCR ステップの最適化が必要になる場合もあります。
長いテンプレートの逆転写には、より長時間高温に耐えられる UltraScript® 2.0 RTase をお勧めします。これは、RNA の長さに応じて二次構造の可能性が高まるため必要になる場合があります。
参考までに以下の論文を掲載します[1]。
Thiel, V. et al. Effective amplification of 20-kb DNA by reverse transcription PCR. Anal Biochem 252 , 62-70, doi:10.1006/abio.1997.2307 (1997).
UltraScript® 2.0 Reverse Transcriptase を使用して miRNA を増幅できますか?
PCR Biosystems 社の RTase はすべて、miRNA の定量と分析に使用できます。ただし、専用のキットは販売しておりません。
次の 2 つのアプローチのいずれかを使用することをお勧めします。
ユニバーサル RT プライマーを使用して、ポリ (A) またはポリ (U) テールを追加し (例: ポリ (U) ポリメラーゼによる)、続いてユニバーサルプライマーを使用して cDNA を合成します[1],[2]。
特定の RT プライマーを使用し、テーリング ステップを省略します[1],[3]-[5]。
これらのアプローチの詳細がよくわからない場合は、ガイドラインとして役立つ以下の参考リストを参照してください。
Dave, V. P. et al. MicroRNA amplification and detection technologies: opportunities and challenges for point of care diagnostics. Lab Invest 99 , 452-469, doi:10.1038/s41374-018-0143-3 (2019).
Mei, Q. et al. A facile and specific assay for quantifying microRNA by an optimized RT-qPCR approach. PLoS One 7 , e46890, doi:10.1371/journal.pone.0046890 (2012).
Chen, C. et al. Real-time quantification of microRNAs by stem-loop RT-PCR. Nucleic Acids Res 33 , e179, doi:10.1093/nar/gni178 (2005).
Raymond, C. K., Roberts, B. S., Garrett-Engele, P., Lim, L. P. & Johnson, J. M. Simple, quantitative primer-extension PCR assay for direct monitoring of microRNAs and short-interfering RNAs. RNA 11 , 1737-1744, doi:10.1261/rna.2148705 (2005).
Androvic, P., Valihrach, L., Elling, J., Sjoback, R. & Kubista, M. Two-tailed RT-qPCR: a novel method for highly accurate miRNA quantification. Nucleic Acids Res 45 , e144, doi:10.1093/nar/gkx588 (2017).
UltraScript® 2.0 Reverse Transcriptase は血液または血漿サンプルに使用できますか??
UltraScript® 2.0 は、血液や血漿中に含まれるさまざまな RT 阻害剤を処理する優れた能力を備えています。RT 反応用の血液/血漿サンプルの量を滴定し、酵素の量を変え、cDNA 産物を希釈して最適化することをお勧めします。プロトコルをさらに微調整するには、「qPCR ステップでの Ct 値が高い場合や、RT ステップ後のゲル上の PCR 産物が少ない場合 (PCR/qPCR の問題) を緩和するにはどうすればよいですか?
UltraScript® 2.0 Reverse Transcriptase はテンプレートの切り替えを行うことができますか?
当社の RTase はすべて、テンプレート切り替えアプリケーションで使用できます。現時点では完全なプロトコルや専用キットは提供していませんが、参考として下記の記事のリストを参照することをお勧めします。
Takada, S. & Mano, H. Profiling of microRNA expression by mRAP. Nat Protoc 2 , 3136-3145, doi:10.1038/nprot.2007.457 (2007).
Picelli, S. et al. Full-length RNA-seq from single cells using Smart-seq2. Nat Protoc 9 , 171-181, doi:10.1038/nprot.2014.006 (2014).
Moldovan, N. et al. Multi-Platform Sequencing Approach Reveals a Novel Transcriptome Profile in Pseudorabies Virus. Front Microbiol 8 , 2708, doi:10.3389/fmicb.2017.02708 (2017).
Zajac, P., Islam, S., Hochgerner, H., Lonnerberg, P. & Linnarsson, S. Base preferences in non-templated nucleotide incorporation by MMLV-derived reverse transcriptases. PLoS One 8 , e85270, doi:10.1371/journal.pone.0085270 (2013).
qPCR ステップでの Ct 値が高い場合や、RT ステップ後のゲル上の PCR 産物が少ない場合 (PCR/qPCR の問題) を緩和するにはどうすればよいですか?
ゲル電気泳動を行って cDNA 産物の量を確認します。RT ステップ後の cDNA 産物の量が十分でない場合は、RTase が Taq を阻害している可能性があります[1]。cDNA 産物を 10 ~ 20 倍に希釈してから、この希釈した反応液 2.5 μL を総反応量 20 μL に加えて、この問題を解決してください。量が異なる場合は、それに応じて調整してください。または、RT ステップの前に酵素自体を 5 倍、10 倍、20 倍、40 倍に希釈してみてください。最適な結果を見つけるためにさらに微調整が必要な場合は、これら 2 つの手順を組み合わせることもできます。
Suslov, O. & Steindler, D. A. PCR inhibition by reverse transcriptase leads to an overestimation of amplification efficiency. Nucleic Acids Res 33 , e181, doi:10.1093/nar/gni176 (2005).
cDNA 収量が低い場合、どのようなトラブルシューティングがありますか?
ダウンストリーム PCR/qPCR 収量や Ct が不十分であることよりも、cDNA 収量が低いことを最初に確認することをお勧めします。後者の場合は、「qPCR ステップでの Ct 値が高い場合や、RT ステップ後のゲル上の PCR 産物が少ない場合 (PCR/qPCR の問題) を緩和するにはどうすればよいですか? UltraScript® 2.0 の使用時に収量が低くなる理由は複数考えられます。
RNA の量または完全性が、後続のエンドポイントまたは qPCR ステップに必要な量の生成物を得るのに不十分である可能性があります。RNA の量を増やしてみるか、ゲル電気泳動や RIN 値を使用して RNA の品質を確認してください。RNA の別の精製プロトコールを検討するか、早い段階で RNase 阻害剤を使用してください。PCR Biosystems 社のすべての RTase には RNase 阻害剤
RNA 調製物には、ヘム、高濃度の NaCl、SDS、チオシアン酸グアニジン、メラニン、カルシウムなどの阻害剤が含まれる場合があります[1]。反応を阻害する可能性のあるすべての物質を除去する別の精製方法を試してください。反応前に RNA を希釈することもできます。これにより理論上の収量は減少しますが、阻害物質も RTase が効率的に機能するのに適したレベルまで希釈されます。これにより、後続のステップに十分な生成物が得られる可能性があります。
一部の RNA は、二次構造や RTase の理想的な基質ではない配列の連続により、本質的に転写が困難です。RTase を添加する前に、温度を上げたり、70°C で 10 分間 RNA 変性/プライマー アニーリングを実行してみます。
RT ステップの後に RNAseH 処理を使用すると、RNA-DNA ヘテロ二本鎖は DNA-DNA 二本鎖よりも安定であるため、特に GC リッチなターゲットの場合、収量が増加します。
配列がまだ十分に表現されていない場合は、特定のプライマーまたはオリゴ (dT) のみを使用した、よりターゲットを絞ったアプローチを使用する必要があるかもしれません。この目的には、ヘキサマーおよびオリゴ (dT) を含まないバッファーが付属する UltraScript® Reverse Transcriptase UltraScript® 2.0 Reverse Transcriptase をお勧めします。
Schrader, C., Schielke, A., Ellerbroek, L. & Johne, R. PCR inhibitors – occurrence, properties and removal. J Appl Microbiol 113, 1014-1026, doi:10.1111/j.1365-2672.2012.05384.x (2012).
UltraScript® と UltraScript® 2.0 Reverse Transcriptase の主な違いは何ですか?
両製品は野生型 MMLV 逆転写酵素から派生したもので、機能を強化する複数の変異を含んでいます。それぞれが優れた RTase です。UltraScript® 2.0 は 65 °C 以上まで耐熱性が高く、阻害剤に耐性があり、最大 3.5 μg の大量の RNA を逆転写できます。UltraScript® 2.0 は、存在する RNA の量が少ないために感度が必要なアプリケーションにも使用できますが、これには現在の配合を使用してユーザー側で大幅な最適化が必要となるため、代わりに UltraScript® Reverse Transcriptase UltraScript® Reverse Transcriptase UltraScript® 2.0 は 2 ステップ プロセス (RT、PCR) の一部としてのみ使用してください。UltraScript® 2.0 は、大量の二次構造を含む長くて扱いにくいテンプレートに特に推奨されます。両方の RTase は、ヘキサマーおよびオリゴ d(T) の有無にかかわらず cDNA 合成キットで使用できます。
RTase による Taq 阻害を回避するために UltraScript® 2.0 を希釈する場合の推奨事項は何ですか?
逆転写の前に UltraScript® 2.0 を希釈
2.5 µLのRTase反応液を20 µLのPCR反応液に移すと仮定(4倍希釈)
RTase による Taq 阻害の効果を無効にするために、RTase を 10 倍 ~ 50 倍に希釈することをお勧めします
希釈には次のバッファーまたは同等のものを推奨します
20 mM Tris/Cl pH 8.0 (25°C)
100 mM KCl
1 mM EDTA
1 mM DTT
5 % (w/v) Tween 20
5% (w/v) Triton X-100
50% (v/v) Glycerol
逆転写後のUltraScript® 2.0 の希釈、つまり反応混合物を希釈
RT 反応混合物を希釈すると、RTase および cDNA の阻害効果が薄れてしまうため、最適な結果を得るには 5 倍から 15 倍までの希釈を推奨します
2.5 µL の RTase 反応を 20 µL の PCR/qPCR 反応に移すと仮定すると、4 倍希釈で合計 20 倍~ 60 倍になります。RT 反応の希釈には水を使用します
UltraScript® 2.0 のダイナミック レンジはどのくらいですか?
全体的に、UltraScript® 2.0 は、20 pg から 3.5 μg までの RNA を逆転写できます。パフォーマンスは、RNA の種類、RNA の品質、および特定のプライマー、オリゴ (T)、またはランダム ヘキサマーが使用されているかどうかによって異なります。5 ng から 3.5 μg の量の RNA を扱う場合は、希釈されていない UltraScript® 2.0 を使用するのが最適です。UltraScript® 2.0 のより高感度なパフォーマンスを必要とするアプリケーションの場合、酵素と cDNA 製品の希釈が必要になる場合があります。「qPCR ステップでの Ct 値が高い場合や、RT ステップ後のゲル上の PCR 産物が少ない場合 (PCR/qPCR の問題) を緩和するにはどうすればよいですか?
UltraScript® 2.0 Reverse Transcriptase のエラー率はどのくらいですか??
市販されている大部分の RTase と同様、UltraScript® 2.0 Reverse Transcriptase および当社が提供する他のすべての RTase は、野生型モロニーマウス白血病ウイルス (MMLV) RTase に由来しており、エラー率は 1×10-4 エラー/bp です[1]。これは、鳥類骨髄芽球症ウイルス (AMV) 由来の RTase にも当てはまります。
反応を高温で実行すると、ミスマッチの塩基対が不安定になるため、忠実度が高まります[2]。忠実度を低くする必要がある場合は、マンガンを追加すると RTase の変異原性が高まり、速度が速くなる可能性があります[3]。
Yasukawa, K. et al. Next-generation sequencing-based analysis of reverse transcriptase fidelity. Biochem Biophys Res Commun 492 , 147-153, doi:10.1016/j.bbrc.2017.07.169 (2017).
Malboeuf, C. M., Isaacs, S. J., Tran, N. H. & Kim, B. Thermal effects on reverse transcription: improvement of accuracy and processivity in cDNA synthesis. Biotechniques 30 , 1074-1078, 1080, 1082, passim, doi:10.2144/01305rr06 (2001).
Cadwell, R. C. & Joyce, G. F. Randomization of genes by PCR mutagenesis. PCR Methods Appl 2 , 28-33 (1992).
UltraScript® 2.0 RTase を使用した後にスメアや非特異的産物が見える場合、どのようなトラブルシューティングがありますか?
RT 反応後にスメアや非特異的生成物が現れるのには、複数の理由が考えられます。トラブルシューティングでは次の点を考慮することができます。
PCR/qPCR ステップが逆転写ステップの下流で実行される場合、問題が逆転写ステップと PCR/qPCR ステップのどちらに関連しているかを確認することが重要です。適切なコントロールを使用して PCR/qPCR 反応のトラブルシューティングを行い、上記の問題を引き起こす可能性のあるステップのリストからこれを除外してください。
スメアリングはプライマーオリゴマー化を示している可能性があります。オリゴマー化は、オリゴマーの設計が不適切で、テンプレートの濃度が低い場合に発生する可能性があります。これにより、プライマーダイマーまたはオフターゲット配列の逆転写が発生します。プライマーの再設計、反応温度の上昇、テンプレートの量の増加、プライマー濃度の低下、または反応時間の短縮をお勧めします。これらの考慮事項は、非特異的バンドにも使用できます。
プライマーはターゲット配列に固有ではない可能性があり、再設計が必要になる場合があります。
反復性の高い配列に対するプライマーはスメアリングを引き起こす可能性があるため、プライマーの再設計を考慮する必要がある場合があります。
RNA が劣化している可能性があります。 RNA の量を増やしてみるか、ゲル電気泳動や RIN 値を使用して RNA の品質を確認してください。RNA の別の精製プロトコルを試すか、早い段階で RNase 阻害剤を使用してください。PCR Biosystems 社のすべての RTase には RNase 阻害剤
RNA を取り扱うときは、手袋、エアロゾルバリア付き容積式ピペットなどの使用など、標準的な予防措置を考慮してください。
DNA 汚染がないことを確認してください。