fast, highly specific and ultra-sensitive cDNA synthesis and real-time PCR in a single tube
qPCRBIO SyGreen® 1-Step Kits 極めて低いコピー数のターゲットを検出するには qPCRBIO SyGreen® 1-Step Detect を、高い RNA テンプレート濃度から迅速かつ正確な結果を得るには qPCRBIO SyGreen® 1-Step Go を選択してください。
この堅牢で市場をリードするプローブ キットを使用すると、シングルプレックスまたはマルチプレックスの発現研究と診断アッセイを信頼性高く実行できます。最適化されたマスターミックスは、qPCR ベースのジェノタイピングおよび対立遺伝子識別研究にも適しています。このミックスは、qPCRBIO Probe Blue Mix
見やすい青色のミックスでピペッティング精度が向上
多重反応における高効率
早期の Ct 値に対する急速な伸長速度
市場をリードする感度 – 検出限界の向上
GCおよびATリッチ配列からの効率的な増幅
抗体媒介ホット スタート技術
すべてのリアルタイム PCR プラットフォームとの互換性
絶対的な定量化
相対的遺伝子発現解析
極度にコピー数の少ないターゲットの検出
qPCRBIO SyGreen® 1-Step Detect は、反応あたり1pg – 10ngの総RNAまたは>0.01pg mRNAのテンプレート量に推奨qPCRBIO SyGreen® 1-Step Go は、反応あたり10pg~100ngの総RNAまたは>0.01pg mRNAのテンプレート量に推奨
qPCRBIO SyGreen® 1-Step Kitsとは? qPCRBIO SyGreen® 1-Step Kits
qPCRBIO SyGreen® 1-Step Kits
qPCRBIO SyGreen® 1-Step Detect は感度を重視して設計されており、コピー数が極めて少ないターゲットの検出に最適です。qPCRBIO SyGreen® 1-Step Go は Ct が最も早く、高テンプレート濃度から迅速かつ正確な結果が得られるように配合されています。
キットには、耐熱性があり極めて活性の高い改良型 MMLV 逆転写酵素 RNase 阻害剤
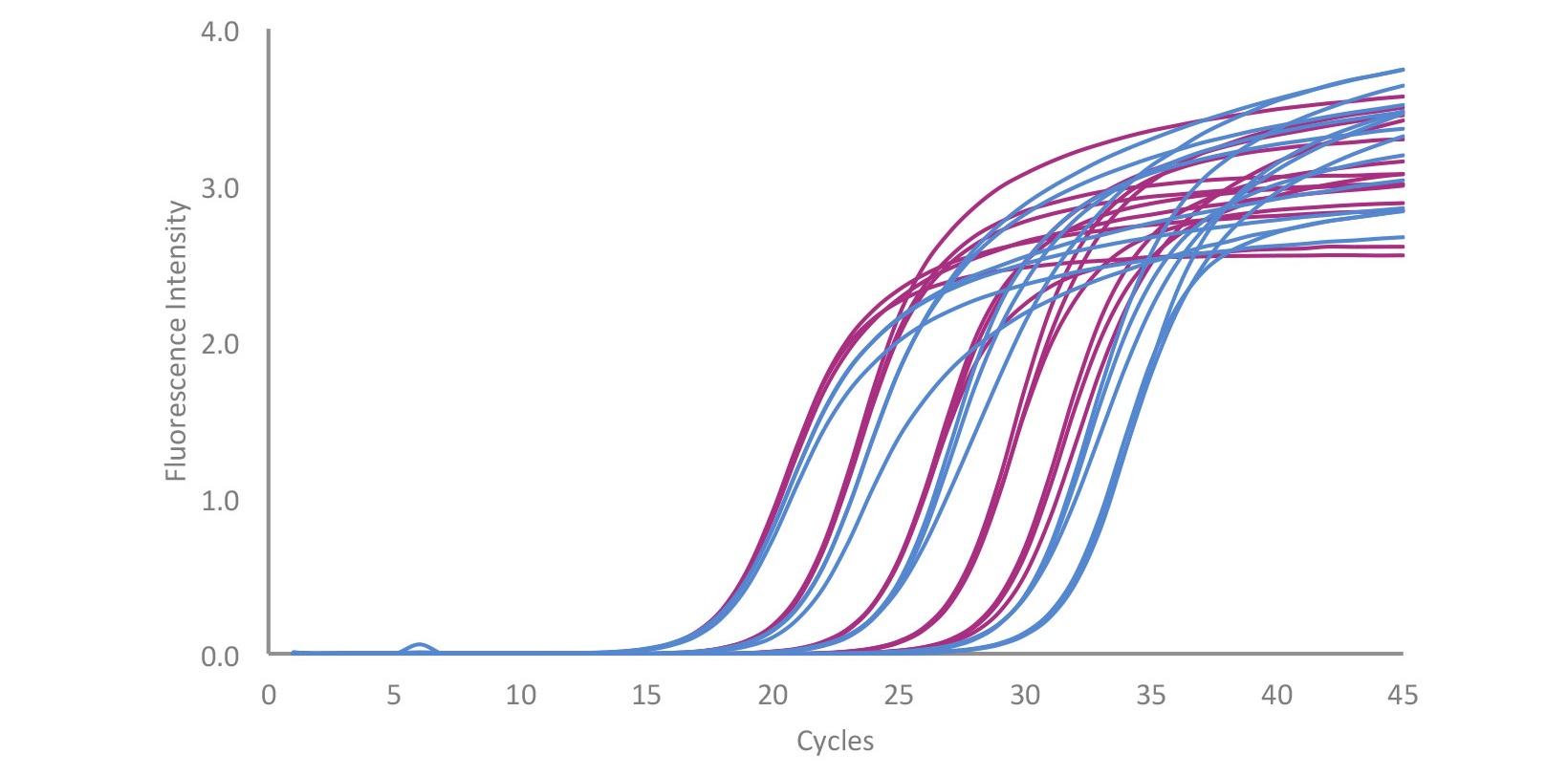
参考データ1:マウスの肝臓から抽出した全RNAの希釈系列からのACTG1遺伝子の増幅トレース:qPCRBIO SyGreen® 1-Step Goと競合他社の比較 qPCRBIO SyGreen® 1-Step Go (紫)と競合他社の Bioline(青)の比較にてマウスの肝臓から抽出した全RNAの希釈系列からのACTG1遺伝子の増幅トレースを示します。全RNA濃度は、20μl反応あたり25pgから250ngまで変化しました。サイクル条件は、cDNA合成に45°C 10分、続いて95°C 2分のホットスタート、その後Roche LC480で95°C 10秒、60°C 10秒を45サイクルでした。qPCRBIO SyGreen® 1-Step Go は、高RNA濃度では同等のパフォーマンスを示し、低RNA濃度では優れたパフォーマンスを示し、増幅曲線間の直線間隔、3~4サイクルの早い増幅、プライマーダイマーの発生率の低下を示しました。
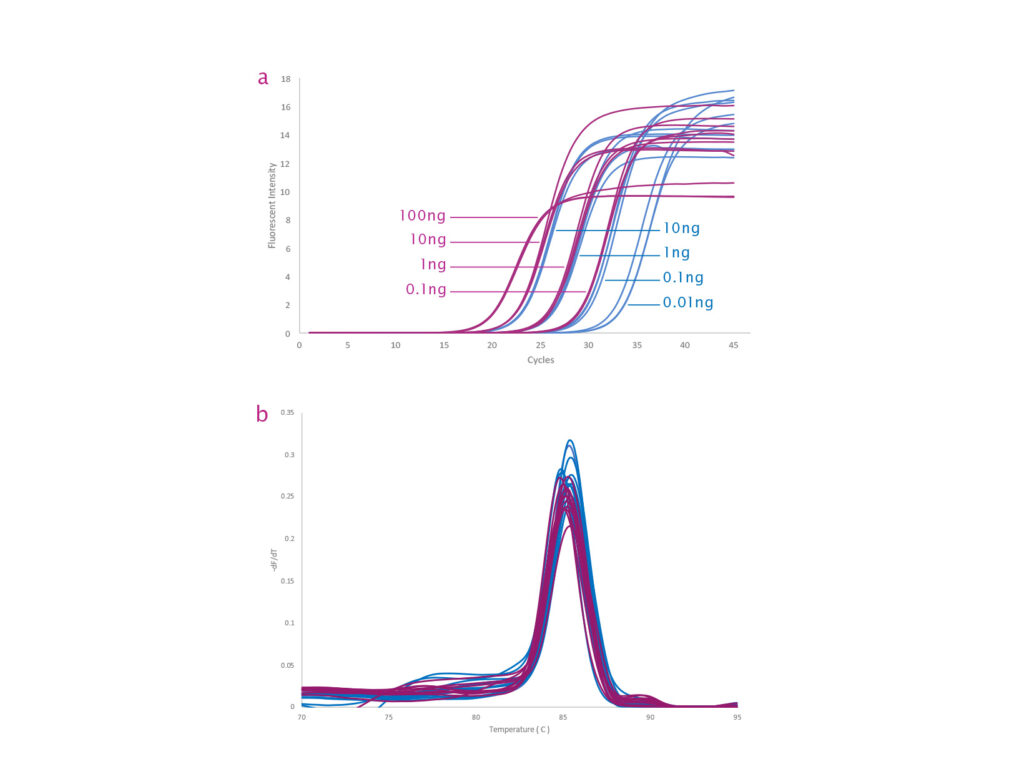
参考データ2:マウスの肝臓から抽出した全RNAの希釈系列からのACTG1遺伝子の増幅トレース:qPCRBIO SyGreen® 1-Step Detect とqPCRBIO SyGreen® 1-Step Go の比較 qPCRBIO SyGreen® 1-Step Detect (青)と qPCRBIO SyGreen® 1-Step Go (紫)の比較。各製品の理想的なテンプレート範囲を示しています。ACTG1 遺伝子は、マウスの肝臓から抽出した全 RNA の希釈系列から増幅されました。qPCRBIO SyGreen® 1-Step Go (紫) は、反応あたり 100 pg ~ 100 ng の範囲で全 RNA を効率的に増幅します。qPCRBIO SyGreen® 1-Step Detect (青) は、反応あたり 10 pg ~ 10 ng の範囲で全 RNA を効率的に増幅します (図 a)。サイクル条件は、cDNA 合成に 45°C 10 分、続いて 95°C 2 分のホット スタート、次に 95°C 10 秒、60°C 30 秒の 45 サイクルで、最後に Roche LC480 で融解分析を行います (図 b)。
qPCRBIO SyGreen® 1-Step Detect Lo-ROX
qPCRBIO SyGreen® 1-Step Detect Hi-ROX
qPCRBIO SyGreen® 1-Step Go Lo-ROX
qPCRBIO SyGreen® 1-Step Go Hi-ROX
Ct 値がどれくらいの値を超えると結果は信頼できなくなりますか?
Ct 値はテンプレート濃度、反応の最適化、機器、研究室によって異なるため、カットオフ Ct 値を選択する際には注意が必要です。一般的に、Ct 値が 35 を超えると、信頼性が低いと見なされ始めます。ただし、テンプレートのコピー数が少ない場合、反応が非効率的になると、遅い Ct が観察されることがあります。相対的または絶対的な定量化方法を使用してカットオフを標準化することは、常に良い方法です。遅い増幅の産物を特定するために、産物の融解曲線または電気泳動で分析することも推奨されます。
qPCRBIO SyGreen® 1-Step Detect / Go をワンステップ RT-PCR とツーステップ RT-PCR の両方に使用できますか?
いいえ、このキットは 2 ステップ反応には使用できません。2 ステップ反応の場合、より難しいターゲットには UltraScript® cDNA Synthesis Kit UltraScript® 2.0 cDNA Synthesis Kit
ROX は反応に悪影響を及ぼす可能性がありますか?
ROX (6-carboxy-X-rhodamine) は、主にウェル間の光路のばらつきによって生じる蛍光レベルの変動を正規化するために、ROX 依存型リアルタイム PCR 機器でパッシブ リファレンス 色素として使用されます。蛍光強度 (Rn) の正規化は、リアルタイム PCR ソフトウェアで、特定の信号の発光強度を ROX の発光強度で割ることによって行われます。
ROX は PCR 反応には関与せず、その蛍光レベルは各ウェルの DNA の量に比例しないため、この蛍光体を混合物に追加すると、増幅中に一定の蛍光信号が得られます。
パッシブ リファレンス スタンダードを必要とするさまざまなタイプのリアルタイム PCR 機器では、主に各システムの光学構成 (つまり、使用される励起源と光学系の種類) が異なるため、ROX の最適濃度が異なります。
ROX の添加量が少なすぎたり多すぎたりすると、非常にノイズの多い信号になり反応の結果に影響を及ぼすため、お客様にとって次のことが非常に重要です:
リアルタイム PCR の結果を最適化するために適切な ROX 濃度を決定する
反応を設定するために使用するソフトウェアで ROX 設定を確認する
最も一般的に使用されるシステム用の便利な選択ツール
ホットスタート DNA ポリメラーゼの活性化時間を変更することはできますか?
ポリメラーゼの活性化には少なくとも 2 分間かけることをお勧めします。最大 15 分間の長時間使用しても、酵素に悪影響を与えることはありません。
1 ステップ反応と 2 ステップ反応のどちらが必要ですか?
1-step
cDNA 合成と PCR 反応の両方が同じミックスで発生します。このオプションは、そのスピードとセットアップの容易さから、ハイスループット アプリケーションに適しています。汚染のリスクも軽減されます。低品質の RNA サンプルや、cDNA をアーカイブまたは別の分析に必要とする場合は、理想的ではありません。
2-step
cDNA 合成と PCR 反応は別々に行われます。cDNA 産物を分析用に保持する必要がある場合は、このオプションの方が適しています。また、反応の最適化のレベルも高くなります。酵素の種類と濃度、RNA 入力、cDNA の濃度を制御できるため、1 ステップ形式に比べて感度が高くなります。
RT 反応で RNase 阻害剤を使用する必要はありますか?
いいえ、RTase Go には劣化を防ぎ感度を高めるための RNase 阻害剤
生成物の低値または遅い Ct 値に関する一般的なトラブルシューティング
Ct 値が異常に遅い場合は、テンプレート RNA を希釈してみてください。これにより、存在する可能性のある阻害物質が反応を阻害しない濃度まで希釈されます。さらに、逆転写ステップを 55 °C に上げ、アニーリング/伸長温度を上げてみてください。これにより、RNA テンプレートやプライマーに存在する二次構造によって生じる問題の解決に役立つ場合があります。
反応阻害が関与している可能性がある場合は、テンプレートの量を減らすか[1]、反応に0.4~4.4 mg/mlのBSAを加えてみてください[2]。
より具体的な問題については、次の情報を添えてお問い合わせ
アンプリコンのサイズ
反応セットアップ
サイクリング条件
増幅トレースと融解プロファイルのスクリーンショット
Scipioni et al. A SYBR Green RT-PCR assay in single tube to detect human and bovine noroviruses and control for inhibition. Virology Journal.5:94 (2008). doi: 1186/1743-422X-5-94
Plante et al. The use of bovine serum albumin to improve the RT‐qPCR detection of foodborne viruses rinsed from vegetable surfaces. Applied Microbiology. 52:3 (2010) doi: https://doi.org/10.1111/j.1472-765X.2010.02989.x
プローブベースのミックスと色素ベースのミックスの違いは何ですか?
qPCRBIO SyGreen® 1-Step Kits などのプローブベースのキットは、感度が高く、非テンプレート増幅が現れる可能性は低くなります。マルチプレックスは、特定のプローブに対して異なる蛍光団を備えたアンプリコンを使用して測定できますが、色素を使用した場合はこれを実現できません。
qPCRBIO SyGreen® 1-Step Detect や 1-Step Go などの色素ベースのシステムは、完全な dsDNA を検出するため、プライマー二量体やオフターゲット/非テンプレート増幅を表示します。これらは、融解曲線を分析することで、生成物のピークから分離できます。
SyGreen® を含むミックスの検出にはどのチャンネルが適切ですか?
SyGreen® は FAM/SYBR チャネルで検出されるはずです。
ご使用の機器が 2 つの色素の分離を可能にしている場合は、SYBR チャネルが推奨される場合があります。
ROX とは何ですか? それは必要ですか?
ROX はパッシブリファレンス色素であり、PCR 反応には関与しません。PCR に関連しない蛍光の変動を標準化するために使用されます。「リソース」セクションの qPCR 選択ツール
qPCRBIO SyGreen® 1-Step Go と qPCRBIO SyGreen® 1-Step Detect の違いは何ですか?
qPCRBIO SyGreen® 1-step Detect
総 RNA 1pg または mRNA 0.01pg の低テンプレート濃度から迅速かつ正確な結果が得られるよう、高い感度を実現するよう設計されています。
qPCRBIO SyGreen® 1-step Go
総 RNA 10pg または mRNA 0.01pg の高テンプレート濃度から迅速かつ正確な結果が得られるよう (早期 Ct) 開発されました。
qPCRBIO SyGreen® 1-Step Kit を他のメーカーのキットと比較する場合、何を考慮すべきでしょうか?
PCR のセットアップとサイクリング条件に関しては、製造元が製品マニュアルで規定している内容に従うことが重要です。また、複数の陽性コントロールを使用し、テンプレート希釈シリーズに対して増幅することもお勧めします。
PCRBIO 1-Step Go RT-PCR キット、qPCRBIO Probe 1-Step Go、qPCRBIO SyGreen® 1-Step Detect|Go キットの違いは何ですか?
PCRBIO 1-step Go RT-PCR キット qPCRBIO Probe 1-Step Go qPCRBIO SyGreen® 1-Step Detect|Go は、それぞれリアルタイム RT-PCR 用のプローブおよび色素ベースのオプションです。
このミックスはマイクロ RNA テンプレートに使用できますか?
はい、qPCRBIO SyGreen® 1-Step Detect|Go はマイクロ RNA テンプレートに使用できます。専用のキットは販売していませんが、当社の RTase
次の 2 つのアプローチのいずれかをお勧めします。
ユニバーサル RT プライマーを使用して、ポリ (A) またはポリ (U) テールを追加し (例: ポリ (U) ポリメラーゼによる)、続いてユニバーサルプライマーを使用して cDNA を合成します。[1], [2]
特定の RT プライマーを使用し、テーリング ステップ を省略します。[1],[3]-[5]
これらのアプローチの詳細がよくわからない場合は、ガイドラインとして以下のリストを参照してください。
Dave, V. P. et al. MicroRNA amplification and detection technologies: opportunities and challenges for point of care diagnostics. Lab Invest 99, 452-469, doi:10.1038/s41374-018-0143-3 (2019).
Mei, Q. et al. A facile and specific assay for quantifying microRNA by an optimized RT-qPCR approach. PLoS One 7, e46890, doi:10.1371/journal.pone.0046890 (2012).
Chen, C. et al. Real-time quantification of microRNAs by stem-loop RT-PCR. Nucleic Acids Res 33, e179, doi:10.1093/nar/gni178 (2005).
Raymond, C. K., Roberts, B. S., Garrett-Engele, P., Lim, L. P. & Johnson, J. M. Simple, quantitative primer-extension PCR assay for direct monitoring of microRNAs and short-interfering RNAs. RNA 11, 1737-1744, doi:10.1261/rna.2148705 (2005).
Androvic, P., Valihrach, L., Elling, J., Sjoback, R. & Kubista, M. Two-tailed RT-qPCR: a novel method for highly accurate miRNA quantification. Nucleic Acids Res 45, e144, doi:10.1093/nar/gkx588 (2017).